info@unicovid.ru
Импортер мед.техники и комплектующих
0
info@unicovid.ru
Импортер мед.техники и комплектующих
0
Запрос на оптовые цены
Сумма минимального заказа на уцененный товар от 9000 руб.
Запрос оптовых цен
Заказ счета
Заполните все поля, пожалуйста.
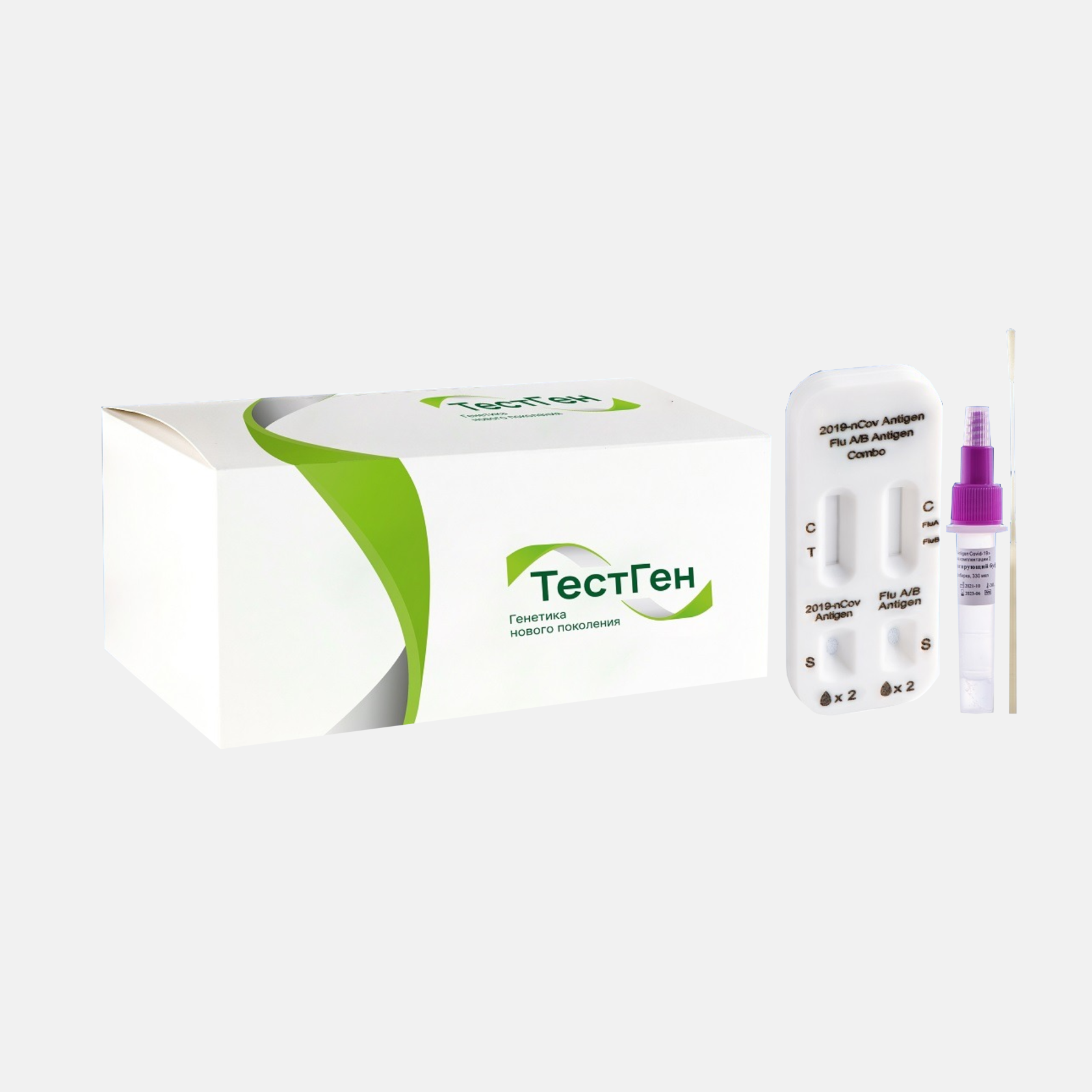
ТЕСТ ГЕН "GT CoV-Influ antigen test"
Время проведения теста
Период применения
10-15 мин.
с 1 по 12 день
Набор реагентов для качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B в клиническом материале человека методом иммунохроматографического анализа, партия 202203-87
Производитель
Заказ от 4500 руб
Отечественный продукт
Для тендеров
Отгрузка через 2 дня
Вирус
COVID, Грипп А/B
Взятие образца
Мазок из носоглотки и ротоглотки
от 80 ₽/тест
Экспресс-тесты на COVID-19 и гриппа А/В от Тест Ген (Россия) - аналог ПЦР-теста, не требующий специального оборудования, позволяет в реальном времени методом (ИХА) выявить антигены коронавируса и гриппа в образцах мазков из носоглотки человека на ранних сроках заболевания.
GT CoV-Influ antigen test является инновационным диагностическим продуктом, который решил проблему идентификации причины схожих между собой симптомов протекания гриппа и коронавируса. Тест производится под торговой маркой "ТЕСТ ГЕН", и является одним из самых востребованных и доступных инструментов диагностики на сегодняшний день, благодаря высоким показаниям точности, удобству использования практически не имеет конкурентов.
Нужно понимать, что экспресс-тест является вспомогательным диагностическим инструментом, результаты всегда должны интерпретироваться в соответствии с клиническими данными и дополнительными диагностическими параметрами. «Тест Ген грипп-ковид» указывает только на наличие/отсутствие антигена вируса в пределах чувствительности теста. Ни количественное значение, ни скорость нарастания концентрации антигена коронавируса SARS-CoV-2 не могут быть определены с помощью этого качественного теста.
Если вы ищете официальный сайт ООО Тест Ген, то наша компания является авторизованным продавцом продукции в России. Бренд отлично зарекомендовал себя среди покупателей: лабораторий, медицинских центров, производственных компаний. Купить Test Gen Экспресс-антиген SARS CoV-2-ИХА-Инфлюенза по оптовым ценам вы можете с нашего склада в Москве и Ульяновске. Если вы находитесь в другом регионе, мы организуем доставку транспортной компанией, проконтролировав соблюдение всех требований к хранению и транспортировке.
GT CoV-Influ antigen test является инновационным диагностическим продуктом, который решил проблему идентификации причины схожих между собой симптомов протекания гриппа и коронавируса. Тест производится под торговой маркой "ТЕСТ ГЕН", и является одним из самых востребованных и доступных инструментов диагностики на сегодняшний день, благодаря высоким показаниям точности, удобству использования практически не имеет конкурентов.
Нужно понимать, что экспресс-тест является вспомогательным диагностическим инструментом, результаты всегда должны интерпретироваться в соответствии с клиническими данными и дополнительными диагностическими параметрами. «Тест Ген грипп-ковид» указывает только на наличие/отсутствие антигена вируса в пределах чувствительности теста. Ни количественное значение, ни скорость нарастания концентрации антигена коронавируса SARS-CoV-2 не могут быть определены с помощью этого качественного теста.
Если вы ищете официальный сайт ООО Тест Ген, то наша компания является авторизованным продавцом продукции в России. Бренд отлично зарекомендовал себя среди покупателей: лабораторий, медицинских центров, производственных компаний. Купить Test Gen Экспресс-антиген SARS CoV-2-ИХА-Инфлюенза по оптовым ценам вы можете с нашего склада в Москве и Ульяновске. Если вы находитесь в другом регионе, мы организуем доставку транспортной компанией, проконтролировав соблюдение всех требований к хранению и транспортировке.
Описание
Чувствительность
Специфичность
92,59%
100%
Время проведения теста
10-15 мин.
Тест Ген Россия
Характеристики
Производитель
Способ забора анализа
25 тестов
от - 30°С до + 30°С
Срок годности
до аперля 2024
COVID-19
ГРИПП А
ГРИПП В
92%
96%
Мазок из нооглотки и ротоглотки
100%
100%
Фасовка
Температура хранегния
Комплектация
В состав «GT CoV-Influ antigen test», партия 202203-87 входят следующие комплектующие:
- Тестовая кассета (в индивидуальной упаковке из фольги в комплекте с осушителем): 25 шт.
- Пробирка с буфером: 25 шт., по 330 мкл.
- Инструкция по применению: 1 шт.
- Паспорт качества: 1 шт.
- Зонд медицинский одноразовый стерильный по ТУ 32.50.13-002-28731857-2020» (РУ № РЗН 2021/13989): 1 шт.
- Пробирка с буфером: 25 шт., по 330 мкл.
- Инструкция по применению: 1 шт.
- Паспорт качества: 1 шт.
- Зонд медицинский одноразовый стерильный по ТУ 32.50.13-002-28731857-2020» (РУ № РЗН 2021/13989): 1 шт.
Инструкция
- Перед тестированием внимательно прочитайте Инструкцию по применению.
- Перед забором образца из ротоглотки нельзя принимать пищу, пить, чистить зубы, полоскать рот/горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить, по крайней мере, за 2 часа до забора биоматериала.
- Перед забором образца из носоглотки нельзя промывать нос, использовать спреи, капли, мази для носа, по крайней мере, за 2 часа до забора биоматериала .
- Перед проведением теста доведите набор реагентов до комнатной температуры (15–30ºC). Не открывайте пакет из фольги, пока не будете готовы к проведению анализа.
- Не открывайте упаковку до тех пор, пока не будете готовы к проведению теста. Одноразовый тест рекомендуется использовать при низкой влажности окружающей среды (RH≤70%) в течение 15 минут. Перед использованием раствор и тестовая карта должны быть комнатной температуры (15– 30ºC ).
- Перед забором образца из ротоглотки нельзя принимать пищу, пить, чистить зубы, полоскать рот/горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить, по крайней мере, за 2 часа до забора биоматериала.
- Перед забором образца из носоглотки нельзя промывать нос, использовать спреи, капли, мази для носа, по крайней мере, за 2 часа до забора биоматериала .
- Перед проведением теста доведите набор реагентов до комнатной температуры (15–30ºC). Не открывайте пакет из фольги, пока не будете готовы к проведению анализа.
- Не открывайте упаковку до тех пор, пока не будете готовы к проведению теста. Одноразовый тест рекомендуется использовать при низкой влажности окружающей среды (RH≤70%) в течение 15 минут. Перед использованием раствор и тестовая карта должны быть комнатной температуры (15– 30ºC ).
1
Откройте упаковку и достаньте тестовую кассету. Положите ее на чистую сухую поверхность.
2
Приготовьте пробирку для пробоподготовки. Откройте пробирку для пробоподготовки, повернув нижнюю часть крышки против часовой стрелки.
3
Поместите образец в пробирку для пробоподготовки, покрутите тампон в течение приблизительно 10–15 секунд. Удалите тампон, прижимая его к стенке пробирки, чтобы выделить 7 из него как можно больше жидкости. Утилизируйте тампоны в соответствии с методом утилизации биологически опасных отходов (класс Б).
4
Закройте крышку, повернув по часовой стрелке. Откройте верхнюю узкую часть крышки, повернув ее против часовой стрелки относительно нижней части, чтобы освободить наконечниккапельницу.
5
Нанесите две капли в каждое отверстие для образца (S) на тестовой кассете.
Для экспресс-теста на антиген SARS-CoV-2:
Положительный результат (антиген SARS-CoV-2 был выявлен): появились как контрольная линия C, так и тестовая линия Т.
Отрицательный результат (антиген SARS-CoV-2 не выявлен): появилась только контрольная линия C, и отсутствует тестовая линия Т.
Недействительный результат: контрольная линия C не появилась, независимо от того, появилась ли тестовая линия Т. Тест должен быть выполнен повторно.
Положительный результат (антиген SARS-CoV-2 был выявлен): появились как контрольная линия C, так и тестовая линия Т.
Отрицательный результат (антиген SARS-CoV-2 не выявлен): появилась только контрольная линия C, и отсутствует тестовая линия Т.
Недействительный результат: контрольная линия C не появилась, независимо от того, появилась ли тестовая линия Т. Тест должен быть выполнен повторно.
Для экспресс-теста на антигены вирусов гриппа A/B:
Положительный результат:
1) антигены вирусов гриппа типов А и B были выявлены, если появились как контрольная линия C, так и тестовые линии FluA и FluB;
2) антиген вируса гриппа типа А выявлен, если появились как контрольная линия C, так и тестовая линия FluA;
3) антиген вируса гриппа типа B выявлен, если появились как контрольная линия C, так и тестовая линия FluB.
Отрицательный результат (антигены гриппа типа А и типа B не выявлены): появилась только контрольная линия C, и отсутствует тестовые линии FluA и FluB/
Недействительный результат: если контрольная линия C не появилась, независимо от того, появились ли одна или обе тестовые линии (FluA / FluB). Тест должен быть выполнен повторно.
Примечание: линия в тестовой зоне (T / FluA / FluB) может иметь разную насыщенность цвета. Однако в течение указанного времени обнаружения, независимо от цвета линии, даже линия очень бледного цвета должна оцениваться как положительный результат.
Положительный результат:
1) антигены вирусов гриппа типов А и B были выявлены, если появились как контрольная линия C, так и тестовые линии FluA и FluB;
2) антиген вируса гриппа типа А выявлен, если появились как контрольная линия C, так и тестовая линия FluA;
3) антиген вируса гриппа типа B выявлен, если появились как контрольная линия C, так и тестовая линия FluB.
Отрицательный результат (антигены гриппа типа А и типа B не выявлены): появилась только контрольная линия C, и отсутствует тестовые линии FluA и FluB/
Недействительный результат: если контрольная линия C не появилась, независимо от того, появились ли одна или обе тестовые линии (FluA / FluB). Тест должен быть выполнен повторно.
Примечание: линия в тестовой зоне (T / FluA / FluB) может иметь разную насыщенность цвета. Однако в течение указанного времени обнаружения, независимо от цвета линии, даже линия очень бледного цвета должна оцениваться как положительный результат.
Экспресс-тесты на COVID-19 и гриппа А/В от Тест Ген (Россия) - аналог ПЦР-теста, не требующий специального оборудования, позволяет в реальном времени методом (ИХА) выявить антигены коронавируса и гриппа в образцах мазков из носоглотки человека на ранних сроках заболевания.
GT CoV-Influ antigen test является инновационным диагностическим продуктом, который решил проблему идентификации причины схожих между собой симптомов протекания гриппа и коронавируса. Тест производится под торговой маркой "ТЕСТ ГЕН", и является одним из самых востребованных и доступных инструментов диагностики на сегодняшний день, благодаря высоким показаниям точности, удобству использования практически не имеет конкурентов.
Нужно понимать, что экспресс-тест является вспомогательным диагностическим инструментом, результаты всегда должны интерпретироваться в соответствии с клиническими данными и дополнительными диагностическими параметрами. «Тест Ген грипп-ковид» указывает только на наличие/отсутствие антигена вируса в пределах чувствительности теста. Ни количественное значение, ни скорость нарастания концентрации антигена коронавируса SARS-CoV-2 не могут быть определены с помощью этого качественного теста.
Если вы ищете официальный сайт ООО Тест Ген, то наша компания является авторизованным продавцом продукции в России. Бренд отлично зарекомендовал себя среди покупателей: лабораторий, медицинских центров, производственных компаний. Купить Test Gen Экспресс-антиген SARS CoV-2-ИХА-Инфлюенза по оптовым ценам вы можете с нашего склада в Москве и Ульяновске. Если вы находитесь в другом регионе, мы организуем доставку транспортной компанией, проконтролировав соблюдение всех требований к хранению и транспортировке.
GT CoV-Influ antigen test является инновационным диагностическим продуктом, который решил проблему идентификации причины схожих между собой симптомов протекания гриппа и коронавируса. Тест производится под торговой маркой "ТЕСТ ГЕН", и является одним из самых востребованных и доступных инструментов диагностики на сегодняшний день, благодаря высоким показаниям точности, удобству использования практически не имеет конкурентов.
Нужно понимать, что экспресс-тест является вспомогательным диагностическим инструментом, результаты всегда должны интерпретироваться в соответствии с клиническими данными и дополнительными диагностическими параметрами. «Тест Ген грипп-ковид» указывает только на наличие/отсутствие антигена вируса в пределах чувствительности теста. Ни количественное значение, ни скорость нарастания концентрации антигена коронавируса SARS-CoV-2 не могут быть определены с помощью этого качественного теста.
Если вы ищете официальный сайт ООО Тест Ген, то наша компания является авторизованным продавцом продукции в России. Бренд отлично зарекомендовал себя среди покупателей: лабораторий, медицинских центров, производственных компаний. Купить Test Gen Экспресс-антиген SARS CoV-2-ИХА-Инфлюенза по оптовым ценам вы можете с нашего склада в Москве и Ульяновске. Если вы находитесь в другом регионе, мы организуем доставку транспортной компанией, проконтролировав соблюдение всех требований к хранению и транспортировке.
Описание
Чувствительность
Специфичность
92,59%
100%
Время проведения теста
10-15 мин.
Тест Ген Россия
Характеристики
Производитель
Способ забора анализа
25 тестов
от - 30°С до + 30°С
Срок годности
до аперля 2024
COVID-19
ГРИПП А
ГРИПП В
92%
96%
Мазок из нооглотки и ротоглотки
100%
100%
Фасовка
Температура хранегния
Комплектация
В состав «GT CoV-Influ antigen test», партия 202203-87 входят следующие комплектующие:
- Тестовая кассета (в индивидуальной упаковке из фольги в комплекте с осушителем): 25 шт.
- Пробирка с буфером: 25 шт., по 330 мкл.
- Инструкция по применению: 1 шт.
- Паспорт качества: 1 шт.
- Зонд медицинский одноразовый стерильный по ТУ 32.50.13-002-28731857-2020» (РУ № РЗН 2021/13989): 1 шт.
- Пробирка с буфером: 25 шт., по 330 мкл.
- Инструкция по применению: 1 шт.
- Паспорт качества: 1 шт.
- Зонд медицинский одноразовый стерильный по ТУ 32.50.13-002-28731857-2020» (РУ № РЗН 2021/13989): 1 шт.

Инструкция
- Перед тестированием внимательно прочитайте Инструкцию по применению.
- Перед забором образца из ротоглотки нельзя принимать пищу, пить, чистить зубы, полоскать рот/горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить, по крайней мере, за 2 часа до забора биоматериала.
- Перед забором образца из носоглотки нельзя промывать нос, использовать спреи, капли, мази для носа, по крайней мере, за 2 часа до забора биоматериала .
- Перед проведением теста доведите набор реагентов до комнатной температуры (15–30ºC). Не открывайте пакет из фольги, пока не будете готовы к проведению анализа.
- Не открывайте упаковку до тех пор, пока не будете готовы к проведению теста. Одноразовый тест рекомендуется использовать при низкой влажности окружающей среды (RH≤70%) в течение 15 минут. Перед использованием раствор и тестовая карта должны быть комнатной температуры (15– 30ºC ).
- Перед забором образца из ротоглотки нельзя принимать пищу, пить, чистить зубы, полоскать рот/горло, использовать спрей-освежитель для ротовой полости, жевать жевательную резинку, курить, по крайней мере, за 2 часа до забора биоматериала.
- Перед забором образца из носоглотки нельзя промывать нос, использовать спреи, капли, мази для носа, по крайней мере, за 2 часа до забора биоматериала .
- Перед проведением теста доведите набор реагентов до комнатной температуры (15–30ºC). Не открывайте пакет из фольги, пока не будете готовы к проведению анализа.
- Не открывайте упаковку до тех пор, пока не будете готовы к проведению теста. Одноразовый тест рекомендуется использовать при низкой влажности окружающей среды (RH≤70%) в течение 15 минут. Перед использованием раствор и тестовая карта должны быть комнатной температуры (15– 30ºC ).
1
Откройте упаковку и достаньте тестовую кассету. Положите ее на чистую сухую поверхность.
2
Приготовьте пробирку для пробоподготовки. Откройте пробирку для пробоподготовки, повернув нижнюю часть крышки против часовой стрелки.
3
Поместите образец в пробирку для пробоподготовки, покрутите тампон в течение приблизительно 10–15 секунд. Удалите тампон, прижимая его к стенке пробирки, чтобы выделить 7 из него как можно больше жидкости. Утилизируйте тампоны в соответствии с методом утилизации биологически опасных отходов (класс Б).
4
Закройте крышку, повернув по часовой стрелке. Откройте верхнюю узкую часть крышки, повернув ее против часовой стрелки относительно нижней части, чтобы освободить наконечниккапельницу.
5
Нанесите две капли в каждое отверстие для образца (S) на тестовой кассете.
Для экспресс-теста на антиген SARS-CoV-2:
Положительный результат (антиген SARS-CoV-2 был выявлен): появились как контрольная линия C, так и тестовая линия Т.
Отрицательный результат (антиген SARS-CoV-2 не выявлен): появилась только контрольная линия C, и отсутствует тестовая линия Т.
Недействительный результат: контрольная линия C не появилась, независимо от того, появилась ли тестовая линия Т. Тест должен быть выполнен повторно.
Положительный результат (антиген SARS-CoV-2 был выявлен): появились как контрольная линия C, так и тестовая линия Т.
Отрицательный результат (антиген SARS-CoV-2 не выявлен): появилась только контрольная линия C, и отсутствует тестовая линия Т.
Недействительный результат: контрольная линия C не появилась, независимо от того, появилась ли тестовая линия Т. Тест должен быть выполнен повторно.
Для экспресс-теста на антигены вирусов гриппа A/B:
Положительный результат:
1) антигены вирусов гриппа типов А и B были выявлены, если появились как контрольная линия C, так и тестовые линии FluA и FluB;
2) антиген вируса гриппа типа А выявлен, если появились как контрольная линия C, так и тестовая линия FluA;
3) антиген вируса гриппа типа B выявлен, если появились как контрольная линия C, так и тестовая линия FluB.
Отрицательный результат (антигены гриппа типа А и типа B не выявлены): появилась только контрольная линия C, и отсутствует тестовые линии FluA и FluB/
Недействительный результат: если контрольная линия C не появилась, независимо от того, появились ли одна или обе тестовые линии (FluA / FluB). Тест должен быть выполнен повторно.
Примечание: линия в тестовой зоне (T / FluA / FluB) может иметь разную насыщенность цвета. Однако в течение указанного времени обнаружения, независимо от цвета линии, даже линия очень бледного цвета должна оцениваться как положительный результат.
Положительный результат:
1) антигены вирусов гриппа типов А и B были выявлены, если появились как контрольная линия C, так и тестовые линии FluA и FluB;
2) антиген вируса гриппа типа А выявлен, если появились как контрольная линия C, так и тестовая линия FluA;
3) антиген вируса гриппа типа B выявлен, если появились как контрольная линия C, так и тестовая линия FluB.
Отрицательный результат (антигены гриппа типа А и типа B не выявлены): появилась только контрольная линия C, и отсутствует тестовые линии FluA и FluB/
Недействительный результат: если контрольная линия C не появилась, независимо от того, появились ли одна или обе тестовые линии (FluA / FluB). Тест должен быть выполнен повторно.
Примечание: линия в тестовой зоне (T / FluA / FluB) может иметь разную насыщенность цвета. Однако в течение указанного времени обнаружения, независимо от цвета линии, даже линия очень бледного цвета должна оцениваться как положительный результат.

Коллеги!
Если у вас есть запрос на продукцию брендов из нашей линейки, мы предлагаем вам работу по системе авторизации покупателя. Что вы получаете:
Если у вас есть запрос на продукцию брендов из нашей линейки, мы предлагаем вам работу по системе авторизации покупателя. Что вы получаете:
Гарантия эксклюзивной работы с вашим заказчиком
Лучшая цена
Помощь в формировании технической документации для торгов
Помните, что лучше работать с партнером, соблюдающим профессиональную этику - обращайтесь в ЮНИКОВИД
Поддержка на торгах
Торующим организациям
ВНИМАНИЕ!
На данную продукцию действует система авторизации покупателей заводом-производителем. Поэтому, чтобы не получить отказ в покупке продукции по минимальной цене на рынке, не отправляйте запросы КП другим поставщикам.
110 ₽
от 200 тестов
100 ₽
от 400 тестов
90 ₽
от 600 тестов
80 ₽
от 800 тестов
Оптовые цены
Мы готовы предложить выгодные условия сотрудничества для дилеров и оптовых покупателей. У нас цена теста ТЕСТ ГЕН "GT CoV-Influ antigen test" на коронавирус ниже! Вступив в клуб наших постоянных клиентов, вы сможете получить дополнительные преференции и участвовать в закрытых распродажах.
Запросить условия можно по почте info@unicovid.ru
Назначение медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека, в качестве средства лабораторной диагностики новой коронавирусной инфекции (COVID-19), вирусов гриппа A и B у пациентов с клинической симптоматикой респираторного заболевания, а также контактных лиц.
Описание целевого аналита.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Научная обоснованность целевого аналита
SARS-CoV-2 принадлежит к роду Betacoronavirus. COVID-19 является острым респираторным инфекционным заболеванием, передающимся воздушно-капельным и контактным путем. Пациенты, инфицированные данным коронавирусом, а также бессимптомные носители, представляют собой основной источник инфекции. Через небольшой промежуток времени после попадания в организм вирусных частиц, в начале их деятельности в клетках органов дыхания, человек уже является заразным. Согласно актуальным данным эпидемиологических исследований, инкубационный период составляет от 1 до 14 дней, в основном от 3 до 7 дней. Наиболее часто встречающиеся проявления заболевания после первичного бессимптомного этапа включают в себя повышение температуры тела, слабость и сухой кашель. В некоторых случаях наблюдаются такие симптомы как заложенность носа, боль в горле, миалгия и другие. Тяжелое течение болезни чаще проявляется наличием одышки, высокой температуры тела (выше 38°C) и болей или сдавленности в области грудной клетки.
Грипп представляет собой острое респираторное вирусное заболевание, которое в основном приводит к поражению дыхательных путей и часто проявляется как эпидемия или пандемия. Инфекция в основном передается воздушно-капельным путем. Вирус распространяется со слизистой оболочки верхних дыхательных путей на весь респираторный тракт и может привести к серьезному воспалению слизистой оболочки бронхов и повреждению сосудов. Были определены виды вируса A, B, C и D (последний не инфицирует людей), внутри которых выделяется множество серотипов. Наиболее частой причиной сезонного гриппа являются вирусы гриппа типа A. Типы вирусов различаются по антигенным свойствам матриксного белка их рибонуклеопротеинов. Определение типа гриппа (А, В или С) дает важные указания для дальнейших действий как клиническому врачу, так и эпидемиологу. Грипп А часто приводит к тяжелому клиническому течению и эпидемическому распространению вируса. Таким образом, во время эпидемии гриппа А на первый план выходит борьба с эпидемией, а также производные меры для защиты человека и населения с учетом тяжести клинических симптомов. Грипп B часто вызывает озноб и лихорадку. Температура тела человека может повышаться до 39–40°С в течение 24 часов. У человека вирусы гриппа В развиваются медленнее, чем вирусы гриппа А. Вирус гриппа B мутирует со скоростью в 2–3 раза ниже, чем тип A, однако тоже достаточно быстро, по этой причине иммунитет к гриппу кратковременный.
Функциональное назначение.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется в качестве средства лабораторной диагностики и дифференциации респираторных инфекций, вызванных SARS-CoV-2 (COVID-19), Influenza A/B virus (грипп А/B) в сочетании с клинической картиной. Положительные результаты теста с использованием набора реагентов «GT CoV-Influ antigen test», партия 202203-87 могут быть использованы в качестве основания для постановки диагноза, в случае отрицательного результата необходимо дополнительно пройти анализ методом ПЦР.
Специфическая патология, состояние или фактор риска, для обнаружения, определения или дифференцирования которого предназначено медицинское изделие для диагностики in vitro.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Тип анализируемого образца.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для использования с образцами мазков со слизистой оболочки носоглотки и ротоглотки человека. Получение биологического материала, пробоподготовка, хранение, последующее обезвреживание и утилизация должны осуществляться согласно инструктивно-методическим документам, регламентирующим выполнение исследований для возбудителя инфекции COVID-19 (I–II группы патогенности), возбудителей гриппа типов А и B (III–IV группы патогенности), инструкции к набору реагентов и в соответствии с СП 3.3686-21 («Санитарно-эпидемиологические требования по профилактике инфекционных болезней», Постановление от 28 января 2021 года N 4), а также с «Временными методическими рекомендациями "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)"». Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
Популяционные, демографические аспекты применения медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека независимо от расы, пола и возраста пациента.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека, в качестве средства лабораторной диагностики новой коронавирусной инфекции (COVID-19), вирусов гриппа A и B у пациентов с клинической симптоматикой респираторного заболевания, а также контактных лиц.
Описание целевого аналита.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Научная обоснованность целевого аналита
SARS-CoV-2 принадлежит к роду Betacoronavirus. COVID-19 является острым респираторным инфекционным заболеванием, передающимся воздушно-капельным и контактным путем. Пациенты, инфицированные данным коронавирусом, а также бессимптомные носители, представляют собой основной источник инфекции. Через небольшой промежуток времени после попадания в организм вирусных частиц, в начале их деятельности в клетках органов дыхания, человек уже является заразным. Согласно актуальным данным эпидемиологических исследований, инкубационный период составляет от 1 до 14 дней, в основном от 3 до 7 дней. Наиболее часто встречающиеся проявления заболевания после первичного бессимптомного этапа включают в себя повышение температуры тела, слабость и сухой кашель. В некоторых случаях наблюдаются такие симптомы как заложенность носа, боль в горле, миалгия и другие. Тяжелое течение болезни чаще проявляется наличием одышки, высокой температуры тела (выше 38°C) и болей или сдавленности в области грудной клетки.
Грипп представляет собой острое респираторное вирусное заболевание, которое в основном приводит к поражению дыхательных путей и часто проявляется как эпидемия или пандемия. Инфекция в основном передается воздушно-капельным путем. Вирус распространяется со слизистой оболочки верхних дыхательных путей на весь респираторный тракт и может привести к серьезному воспалению слизистой оболочки бронхов и повреждению сосудов. Были определены виды вируса A, B, C и D (последний не инфицирует людей), внутри которых выделяется множество серотипов. Наиболее частой причиной сезонного гриппа являются вирусы гриппа типа A. Типы вирусов различаются по антигенным свойствам матриксного белка их рибонуклеопротеинов. Определение типа гриппа (А, В или С) дает важные указания для дальнейших действий как клиническому врачу, так и эпидемиологу. Грипп А часто приводит к тяжелому клиническому течению и эпидемическому распространению вируса. Таким образом, во время эпидемии гриппа А на первый план выходит борьба с эпидемией, а также производные меры для защиты человека и населения с учетом тяжести клинических симптомов. Грипп B часто вызывает озноб и лихорадку. Температура тела человека может повышаться до 39–40°С в течение 24 часов. У человека вирусы гриппа В развиваются медленнее, чем вирусы гриппа А. Вирус гриппа B мутирует со скоростью в 2–3 раза ниже, чем тип A, однако тоже достаточно быстро, по этой причине иммунитет к гриппу кратковременный.
Функциональное назначение.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется в качестве средства лабораторной диагностики и дифференциации респираторных инфекций, вызванных SARS-CoV-2 (COVID-19), Influenza A/B virus (грипп А/B) в сочетании с клинической картиной. Положительные результаты теста с использованием набора реагентов «GT CoV-Influ antigen test», партия 202203-87 могут быть использованы в качестве основания для постановки диагноза, в случае отрицательного результата необходимо дополнительно пройти анализ методом ПЦР.
Специфическая патология, состояние или фактор риска, для обнаружения, определения или дифференцирования которого предназначено медицинское изделие для диагностики in vitro.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Тип анализируемого образца.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для использования с образцами мазков со слизистой оболочки носоглотки и ротоглотки человека. Получение биологического материала, пробоподготовка, хранение, последующее обезвреживание и утилизация должны осуществляться согласно инструктивно-методическим документам, регламентирующим выполнение исследований для возбудителя инфекции COVID-19 (I–II группы патогенности), возбудителей гриппа типов А и B (III–IV группы патогенности), инструкции к набору реагентов и в соответствии с СП 3.3686-21 («Санитарно-эпидемиологические требования по профилактике инфекционных болезней», Постановление от 28 января 2021 года N 4), а также с «Временными методическими рекомендациями "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)"». Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
Популяционные, демографические аспекты применения медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека независимо от расы, пола и возраста пациента.
Показанием к применению набора реагентов «GT CoV-Influ antigen test», партия 202203-87 является необходимость качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B в мазках со слизистой оболочки носоглотки и ротоглотки человека для этиологической лабораторной диагностики и дифференциации COVID-19 и гриппа типов А и B.
При использовании по назначению и в соответствии с настоящей инструкцией противопоказаний и побочных действий к применению изделия нет. Абсолютных противопоказаний для получения мазков из носоглотки и ротоглотки нет. Относительные противопоказания для получения мазка из носоглотки включают: недавнюю травму или анатомические дефекты лицевой части черепа и тяжелый геморрагический диатез – они могут препятствовать введению зонда или увеличивать риск локальных травм и кровотечений.
При использовании по назначению и в соответствии с настоящей инструкцией противопоказаний и побочных действий к применению изделия нет. Абсолютных противопоказаний для получения мазков из носоглотки и ротоглотки нет. Относительные противопоказания для получения мазка из носоглотки включают: недавнюю травму или анатомические дефекты лицевой части черепа и тяжелый геморрагический диатез – они могут препятствовать введению зонда или увеличивать риск локальных травм и кровотечений.
В наборе «GT CoV-Influ antigen test», партия 202203-87 используется метод иммунохроматографического анализа с коллоидным золотом. Образец продвигается вперед по тест-полоске вследствие капиллярного эффекта. Если образец содержит в достаточном количестве антигены вирусов гриппа типов А и B или антиген SARS-CoV-2, эти антигены связываются с мечеными коллоидным золотом моноклональными антителами. На границе тестовой линии иммунный комплекс захватывается другими моноклональными антителами к вирусу гриппа А / вирусу гриппа B / SARS-CoV-2, которые закреплены на мембране, в результате чего образуется линия розового цвета в данной зоне (T/ FluA / FluВ) кассеты, свидетельствующая о положительном результате. Отсутствие линии указывает на отрицательный результат. Тест-полоска также имеет контрольную линию в зоне C, которая окрашивается розовым независимо от того, появилась ли линия выявления антигена, и является контролем правильного проведения теста.
Ограничения метода
1. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для диагностики in vitro.
2. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для тестирования мазков из носоглотки и ротоглотки человека. В случае использования других образцов результаты могут быть неверными.
3. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для качественного выявления и не может указывать на уровень антигенов в образце.
4. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 является вспомогательным клиническим диагностическим средством. Если результат теста положительный, то рекомендуется незамедлительно обратиться к другим методам для дальнейшего обследования. Диагноз врача имеет преимущественное значение.
5. На ранней стадии инфекции могут быть получены отрицательные результаты, поскольку уровень антигена низок или антиген еще не появился в образце.
Меры предостороженности
1. Класс в зависимости от потенциального риска применения – 3 в соответствии с номенклатурной классификацией медицинских изделий, утверждаемой приказом Министерства здравоохранения Российской Федерации от 06.06.2012 N 4н (в редакции приказа Минздрава России от 25.09.2014 № 557н «О внесении изменения в приложение № 1 к приказу Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации медицинских изделий»).
2. Внимательно ознакомьтесь с инструкцией перед использованием и строго контролируйте время реакции. В противном случае результаты теста будут неточными.
3. Образец должен тестироваться в лаборатории. Со всеми образцами и материалами во время тестирования следует обращаться в соответствии с лабораторной практикой по инфекционным заболеваниям, а также в соответствии с п. 4.2.3 «Временных методических рекомендаций "Профилактика, диагностика и лечение новой коронавирусной инфекции COVID19"»:
Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
К работе с тест-системами для диагностики COVID-19 в лаборатории организаций допускаются специалисты, давшие письменное согласие и прошедшие инструктаж, проведенный сотрудниками лабораторий Роспотребнадзора, имеющих санитарно-эпидемиологическое заключение на работу с возбудителями инфекционных заболеваний человека II группы патогенности.
Сбор клинического материала и его упаковку осуществляет работник медицинской организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность микроорганизмами II группы патогенности. Каждый образец материала помещают в отдельную транспортную емкость, обеспечивая требования в соответствии с таблицей настоящих методических рекомендаций.
Все образцы, собранные для лабораторных исследований, должны рассматриваться как потенциально инфекционные, и медицинский персонал, который собирает или перевозит клинические образцы, должен строго соблюдать требования биологической безопасности как при работе с микроорганизмами II группы патогенности.
Перевозка образцов должна осуществляться в соответствии с требованиями санитарного законодательства по отношению к микроорганизмам II группы патогенности.
4. Берегите от влаги, не открывайте упаковку, пока образцы для тестирования не будут готовы. Не проводите тестирование, если упаковка повреждена или тестовая кассета является влажной.
5. Используйте набор реагентов в течение срока годности.
6. Перед использованием доведите все реагенты и образцы до комнатной температуры.
7. Не заменяйте компоненты набора компонентами других наборов.
8. Не разбавляйте образец для тестирования.
9. Набор реагентов должен храниться в строгом соответствии с условиями, указанными в данной инструкции.
10. Методы и результаты тестирования должны интерпретироваться в строгом соответствии с данной инструкцией.
11. Если содержание в пробе антигенов SARS-CoV-2 / вирусов гриппа типов A и B в образце окажется ниже минимального предела выявления для данного набора, то будут получены отрицательные результаты.
1. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для диагностики in vitro.
2. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для тестирования мазков из носоглотки и ротоглотки человека. В случае использования других образцов результаты могут быть неверными.
3. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для качественного выявления и не может указывать на уровень антигенов в образце.
4. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 является вспомогательным клиническим диагностическим средством. Если результат теста положительный, то рекомендуется незамедлительно обратиться к другим методам для дальнейшего обследования. Диагноз врача имеет преимущественное значение.
5. На ранней стадии инфекции могут быть получены отрицательные результаты, поскольку уровень антигена низок или антиген еще не появился в образце.
Меры предостороженности
1. Класс в зависимости от потенциального риска применения – 3 в соответствии с номенклатурной классификацией медицинских изделий, утверждаемой приказом Министерства здравоохранения Российской Федерации от 06.06.2012 N 4н (в редакции приказа Минздрава России от 25.09.2014 № 557н «О внесении изменения в приложение № 1 к приказу Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации медицинских изделий»).
2. Внимательно ознакомьтесь с инструкцией перед использованием и строго контролируйте время реакции. В противном случае результаты теста будут неточными.
3. Образец должен тестироваться в лаборатории. Со всеми образцами и материалами во время тестирования следует обращаться в соответствии с лабораторной практикой по инфекционным заболеваниям, а также в соответствии с п. 4.2.3 «Временных методических рекомендаций "Профилактика, диагностика и лечение новой коронавирусной инфекции COVID19"»:
Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
К работе с тест-системами для диагностики COVID-19 в лаборатории организаций допускаются специалисты, давшие письменное согласие и прошедшие инструктаж, проведенный сотрудниками лабораторий Роспотребнадзора, имеющих санитарно-эпидемиологическое заключение на работу с возбудителями инфекционных заболеваний человека II группы патогенности.
Сбор клинического материала и его упаковку осуществляет работник медицинской организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность микроорганизмами II группы патогенности. Каждый образец материала помещают в отдельную транспортную емкость, обеспечивая требования в соответствии с таблицей настоящих методических рекомендаций.
Все образцы, собранные для лабораторных исследований, должны рассматриваться как потенциально инфекционные, и медицинский персонал, который собирает или перевозит клинические образцы, должен строго соблюдать требования биологической безопасности как при работе с микроорганизмами II группы патогенности.
Перевозка образцов должна осуществляться в соответствии с требованиями санитарного законодательства по отношению к микроорганизмам II группы патогенности.
4. Берегите от влаги, не открывайте упаковку, пока образцы для тестирования не будут готовы. Не проводите тестирование, если упаковка повреждена или тестовая кассета является влажной.
5. Используйте набор реагентов в течение срока годности.
6. Перед использованием доведите все реагенты и образцы до комнатной температуры.
7. Не заменяйте компоненты набора компонентами других наборов.
8. Не разбавляйте образец для тестирования.
9. Набор реагентов должен храниться в строгом соответствии с условиями, указанными в данной инструкции.
10. Методы и результаты тестирования должны интерпретироваться в строгом соответствии с данной инструкцией.
11. Если содержание в пробе антигенов SARS-CoV-2 / вирусов гриппа типов A и B в образце окажется ниже минимального предела выявления для данного набора, то будут получены отрицательные результаты.

Технические характеристики набора реагентов «GT CoV-Influ antigen test», партия 202203-87.


Для проведения клинических испытаний было использовано 86 образцов мазков из носоглотки, 87 образец мазков из ротоглотки, содержащих исследуемые РНК коронавирусной инфекции SARS-CoV-2, вируса гриппа A и вируса гриппа B, а также для оценки перекрестной реактивности образцы, не содержащие исследуемые аналиты, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ), вирусы парагриппа, риновирусы, аденовирусы, человеческие метапневмовирусы), которые были получены из банка остаточных аликвот, сформированного в процессе рутинной лечебно-диагностической практики ФГБУ ФНКЦ ФМБА России, а также подученные из коллекции ФГБУ «НИИ гриппа имени А.А. Смородинцева».
Такое количество образцов было набрано в соответствии с рекомендациями Типовой программы клинических испытаний, а также в соответствии с требованиями ГОСТ Р 51352-2013 и с учетом рекомендаций Международного руководства CLSI EP09-A3.
В ходе клинических испытаний, для установления статуса РНК коронавируса SARS-CoV-2 и вирусов гриппа А, В, использовался зарегистрированный в установленном порядке набор реагентов:
- «Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) и вирусов гриппа А, В, субтипа H1pdm09 (пандемического) гриппа А методом ОТ-ПЦР в режиме "реального времени" "АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)"» LOT: 171021 срок годности до 17.10.2022 производства ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Для клинического материала, не содержащего РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но содержащего другие возбудители инфекционных заболеваний, использовался «Набор реагентов для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса (human Respiratory Syncytial virus - hRSv), метапневмовируса (human Metapneumovirus - hMpv), вирусов парагриппа 1,2, 3 и 4 типов (human Parainfluenza virus - 1-4 - hPiv), коронавирусов (human Coronavirus - hCov), риновирусов (human Rhinovirus - hRv), ДНК аденовирусов групп В, С и Е (human Adenovirus В, С, Е - hAdv) и бокавируса (human Bocavirus - hBov) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® ОРВИ-скрин-FL" по ТУ 9398-155-01897593-2010», производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия (Регистрационное Удостоверение № ФСР 2011/11258 от 26.02.2019).
Испытания проводились по средствам параллельного проспективного исследования диагностических характеристик набора реагентов «GT CoV-Influ antigen test», партия 202203-87 на основании сопоставления результатов тестирования одних и тех же проб клинического материала испытуемым набором реагентов «GT CoV-Influ antigen test», партия 202203-87, производства ООО «ТестГен» и набором сравнения «АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)», ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Свидетельством правильности работы исследуемого медицинского изделия будет совпадение результатов.
При тестировании 86 образцов мазков из носоглотки испытуемым набором реагентов было определено, что:
- у 27 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 25 пациентов (2 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациента (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 24 пациентов (1 ложноотрицательный результат);
При испытании 9 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 2 образца, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
При тестировании 87 образцов мазков из ротоглотки испытуемым набором реагентов было определено, что:
- у 29 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 26 пациентов (3 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациентов (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 23 пациентов (2 ложноотрицательных результата);
При испытании 8 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 1 образец, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
Доверительные интервалы (ДИ) диагностических характеристик будут рассчитаны по методу Клоппера и Пирсона (Clopper-Pearson Confidience Interval; Clopper, C., & Pearson, E. (1934). The Use of Confidence or Fiducial Limits Illustrated in the Case of the Binomial. Biometrika,26(4), 404- 413. doi:10.2307/2331986). Диагностические характеристики испытуемого набора были рассчитаны с доверительной вероятностью 95 %.
Диагностические характеристики испытуемого набора по отношению к каждому исследуемому аналиту в образцах клинического материала человека (мазки из носоглотки, мазки из ротоглотки) приведен в Таблице 4
Такое количество образцов было набрано в соответствии с рекомендациями Типовой программы клинических испытаний, а также в соответствии с требованиями ГОСТ Р 51352-2013 и с учетом рекомендаций Международного руководства CLSI EP09-A3.
В ходе клинических испытаний, для установления статуса РНК коронавируса SARS-CoV-2 и вирусов гриппа А, В, использовался зарегистрированный в установленном порядке набор реагентов:
- «Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) и вирусов гриппа А, В, субтипа H1pdm09 (пандемического) гриппа А методом ОТ-ПЦР в режиме "реального времени" "АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)"» LOT: 171021 срок годности до 17.10.2022 производства ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Для клинического материала, не содержащего РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но содержащего другие возбудители инфекционных заболеваний, использовался «Набор реагентов для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса (human Respiratory Syncytial virus - hRSv), метапневмовируса (human Metapneumovirus - hMpv), вирусов парагриппа 1,2, 3 и 4 типов (human Parainfluenza virus - 1-4 - hPiv), коронавирусов (human Coronavirus - hCov), риновирусов (human Rhinovirus - hRv), ДНК аденовирусов групп В, С и Е (human Adenovirus В, С, Е - hAdv) и бокавируса (human Bocavirus - hBov) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® ОРВИ-скрин-FL" по ТУ 9398-155-01897593-2010», производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия (Регистрационное Удостоверение № ФСР 2011/11258 от 26.02.2019).
Испытания проводились по средствам параллельного проспективного исследования диагностических характеристик набора реагентов «GT CoV-Influ antigen test», партия 202203-87 на основании сопоставления результатов тестирования одних и тех же проб клинического материала испытуемым набором реагентов «GT CoV-Influ antigen test», партия 202203-87, производства ООО «ТестГен» и набором сравнения «АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)», ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Свидетельством правильности работы исследуемого медицинского изделия будет совпадение результатов.
При тестировании 86 образцов мазков из носоглотки испытуемым набором реагентов было определено, что:
- у 27 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 25 пациентов (2 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациента (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 24 пациентов (1 ложноотрицательный результат);
При испытании 9 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 2 образца, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
При тестировании 87 образцов мазков из ротоглотки испытуемым набором реагентов было определено, что:
- у 29 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 26 пациентов (3 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациентов (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 23 пациентов (2 ложноотрицательных результата);
При испытании 8 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 1 образец, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
Доверительные интервалы (ДИ) диагностических характеристик будут рассчитаны по методу Клоппера и Пирсона (Clopper-Pearson Confidience Interval; Clopper, C., & Pearson, E. (1934). The Use of Confidence or Fiducial Limits Illustrated in the Case of the Binomial. Biometrika,26(4), 404- 413. doi:10.2307/2331986). Диагностические характеристики испытуемого набора были рассчитаны с доверительной вероятностью 95 %.
Диагностические характеристики испытуемого набора по отношению к каждому исследуемому аналиту в образцах клинического материала человека (мазки из носоглотки, мазки из ротоглотки) приведен в Таблице 4
Назначение медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека, в качестве средства лабораторной диагностики новой коронавирусной инфекции (COVID-19), вирусов гриппа A и B у пациентов с клинической симптоматикой респираторного заболевания, а также контактных лиц.
Описание целевого аналита.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Научная обоснованность целевого аналита
SARS-CoV-2 принадлежит к роду Betacoronavirus. COVID-19 является острым респираторным инфекционным заболеванием, передающимся воздушно-капельным и контактным путем. Пациенты, инфицированные данным коронавирусом, а также бессимптомные носители, представляют собой основной источник инфекции. Через небольшой промежуток времени после попадания в организм вирусных частиц, в начале их деятельности в клетках органов дыхания, человек уже является заразным. Согласно актуальным данным эпидемиологических исследований, инкубационный период составляет от 1 до 14 дней, в основном от 3 до 7 дней. Наиболее часто встречающиеся проявления заболевания после первичного бессимптомного этапа включают в себя повышение температуры тела, слабость и сухой кашель. В некоторых случаях наблюдаются такие симптомы как заложенность носа, боль в горле, миалгия и другие. Тяжелое течение болезни чаще проявляется наличием одышки, высокой температуры тела (выше 38°C) и болей или сдавленности в области грудной клетки.
Грипп представляет собой острое респираторное вирусное заболевание, которое в основном приводит к поражению дыхательных путей и часто проявляется как эпидемия или пандемия. Инфекция в основном передается воздушно-капельным путем. Вирус распространяется со слизистой оболочки верхних дыхательных путей на весь респираторный тракт и может привести к серьезному воспалению слизистой оболочки бронхов и повреждению сосудов. Были определены виды вируса A, B, C и D (последний не инфицирует людей), внутри которых выделяется множество серотипов. Наиболее частой причиной сезонного гриппа являются вирусы гриппа типа A. Типы вирусов различаются по антигенным свойствам матриксного белка их рибонуклеопротеинов. Определение типа гриппа (А, В или С) дает важные указания для дальнейших действий как клиническому врачу, так и эпидемиологу. Грипп А часто приводит к тяжелому клиническому течению и эпидемическому распространению вируса. Таким образом, во время эпидемии гриппа А на первый план выходит борьба с эпидемией, а также производные меры для защиты человека и населения с учетом тяжести клинических симптомов. Грипп B часто вызывает озноб и лихорадку. Температура тела человека может повышаться до 39–40°С в течение 24 часов. У человека вирусы гриппа В развиваются медленнее, чем вирусы гриппа А. Вирус гриппа B мутирует со скоростью в 2–3 раза ниже, чем тип A, однако тоже достаточно быстро, по этой причине иммунитет к гриппу кратковременный.
Функциональное назначение.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется в качестве средства лабораторной диагностики и дифференциации респираторных инфекций, вызванных SARS-CoV-2 (COVID-19), Influenza A/B virus (грипп А/B) в сочетании с клинической картиной. Положительные результаты теста с использованием набора реагентов «GT CoV-Influ antigen test», партия 202203-87 могут быть использованы в качестве основания для постановки диагноза, в случае отрицательного результата необходимо дополнительно пройти анализ методом ПЦР.
Специфическая патология, состояние или фактор риска, для обнаружения, определения или дифференцирования которого предназначено медицинское изделие для диагностики in vitro.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Тип анализируемого образца.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для использования с образцами мазков со слизистой оболочки носоглотки и ротоглотки человека. Получение биологического материала, пробоподготовка, хранение, последующее обезвреживание и утилизация должны осуществляться согласно инструктивно-методическим документам, регламентирующим выполнение исследований для возбудителя инфекции COVID-19 (I–II группы патогенности), возбудителей гриппа типов А и B (III–IV группы патогенности), инструкции к набору реагентов и в соответствии с СП 3.3686-21 («Санитарно-эпидемиологические требования по профилактике инфекционных болезней», Постановление от 28 января 2021 года N 4), а также с «Временными методическими рекомендациями "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)"». Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
Популяционные, демографические аспекты применения медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека независимо от расы, пола и возраста пациента.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека, в качестве средства лабораторной диагностики новой коронавирусной инфекции (COVID-19), вирусов гриппа A и B у пациентов с клинической симптоматикой респираторного заболевания, а также контактных лиц.
Описание целевого аналита.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Научная обоснованность целевого аналита
SARS-CoV-2 принадлежит к роду Betacoronavirus. COVID-19 является острым респираторным инфекционным заболеванием, передающимся воздушно-капельным и контактным путем. Пациенты, инфицированные данным коронавирусом, а также бессимптомные носители, представляют собой основной источник инфекции. Через небольшой промежуток времени после попадания в организм вирусных частиц, в начале их деятельности в клетках органов дыхания, человек уже является заразным. Согласно актуальным данным эпидемиологических исследований, инкубационный период составляет от 1 до 14 дней, в основном от 3 до 7 дней. Наиболее часто встречающиеся проявления заболевания после первичного бессимптомного этапа включают в себя повышение температуры тела, слабость и сухой кашель. В некоторых случаях наблюдаются такие симптомы как заложенность носа, боль в горле, миалгия и другие. Тяжелое течение болезни чаще проявляется наличием одышки, высокой температуры тела (выше 38°C) и болей или сдавленности в области грудной клетки.
Грипп представляет собой острое респираторное вирусное заболевание, которое в основном приводит к поражению дыхательных путей и часто проявляется как эпидемия или пандемия. Инфекция в основном передается воздушно-капельным путем. Вирус распространяется со слизистой оболочки верхних дыхательных путей на весь респираторный тракт и может привести к серьезному воспалению слизистой оболочки бронхов и повреждению сосудов. Были определены виды вируса A, B, C и D (последний не инфицирует людей), внутри которых выделяется множество серотипов. Наиболее частой причиной сезонного гриппа являются вирусы гриппа типа A. Типы вирусов различаются по антигенным свойствам матриксного белка их рибонуклеопротеинов. Определение типа гриппа (А, В или С) дает важные указания для дальнейших действий как клиническому врачу, так и эпидемиологу. Грипп А часто приводит к тяжелому клиническому течению и эпидемическому распространению вируса. Таким образом, во время эпидемии гриппа А на первый план выходит борьба с эпидемией, а также производные меры для защиты человека и населения с учетом тяжести клинических симптомов. Грипп B часто вызывает озноб и лихорадку. Температура тела человека может повышаться до 39–40°С в течение 24 часов. У человека вирусы гриппа В развиваются медленнее, чем вирусы гриппа А. Вирус гриппа B мутирует со скоростью в 2–3 раза ниже, чем тип A, однако тоже достаточно быстро, по этой причине иммунитет к гриппу кратковременный.
Функциональное назначение.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется в качестве средства лабораторной диагностики и дифференциации респираторных инфекций, вызванных SARS-CoV-2 (COVID-19), Influenza A/B virus (грипп А/B) в сочетании с клинической картиной. Положительные результаты теста с использованием набора реагентов «GT CoV-Influ antigen test», партия 202203-87 могут быть использованы в качестве основания для постановки диагноза, в случае отрицательного результата необходимо дополнительно пройти анализ методом ПЦР.
Специфическая патология, состояние или фактор риска, для обнаружения, определения или дифференцирования которого предназначено медицинское изделие для диагностики in vitro.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вируса гриппа A (Influenza A virus) и вируса гриппа В (Influenza B virus) методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека.
Тип анализируемого образца.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 предназначен для использования с образцами мазков со слизистой оболочки носоглотки и ротоглотки человека. Получение биологического материала, пробоподготовка, хранение, последующее обезвреживание и утилизация должны осуществляться согласно инструктивно-методическим документам, регламентирующим выполнение исследований для возбудителя инфекции COVID-19 (I–II группы патогенности), возбудителей гриппа типов А и B (III–IV группы патогенности), инструкции к набору реагентов и в соответствии с СП 3.3686-21 («Санитарно-эпидемиологические требования по профилактике инфекционных болезней», Постановление от 28 января 2021 года N 4), а также с «Временными методическими рекомендациями "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)"». Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
Популяционные, демографические аспекты применения медицинского изделия.
Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 применяется для качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B методом иммунохроматографического анализа с коллоидным золотом в мазках со слизистой оболочки носоглотки и ротоглотки человека независимо от расы, пола и возраста пациента.
Показанием к применению набора реагентов «GT CoV-Influ antigen test», партия 202203-87 является необходимость качественного выявления антигенов SARS-CoV-2, вирусов гриппа типов A и B в мазках со слизистой оболочки носоглотки и ротоглотки человека для этиологической лабораторной диагностики и дифференциации COVID-19 и гриппа типов А и B.
При использовании по назначению и в соответствии с настоящей инструкцией противопоказаний и побочных действий к применению изделия нет. Абсолютных противопоказаний для получения мазков из носоглотки и ротоглотки нет. Относительные противопоказания для получения мазка из носоглотки включают: недавнюю травму или анатомические дефекты лицевой части черепа и тяжелый геморрагический диатез – они могут препятствовать введению зонда или увеличивать риск локальных травм и кровотечений.
При использовании по назначению и в соответствии с настоящей инструкцией противопоказаний и побочных действий к применению изделия нет. Абсолютных противопоказаний для получения мазков из носоглотки и ротоглотки нет. Относительные противопоказания для получения мазка из носоглотки включают: недавнюю травму или анатомические дефекты лицевой части черепа и тяжелый геморрагический диатез – они могут препятствовать введению зонда или увеличивать риск локальных травм и кровотечений.
В наборе «GT CoV-Influ antigen test», партия 202203-87 используется метод иммунохроматографического анализа с коллоидным золотом. Образец продвигается вперед по тест-полоске вследствие капиллярного эффекта. Если образец содержит в достаточном количестве антигены вирусов гриппа типов А и B или антиген SARS-CoV-2, эти антигены связываются с мечеными коллоидным золотом моноклональными антителами. На границе тестовой линии иммунный комплекс захватывается другими моноклональными антителами к вирусу гриппа А / вирусу гриппа B / SARS-CoV-2, которые закреплены на мембране, в результате чего образуется линия розового цвета в данной зоне (T/ FluA / FluВ) кассеты, свидетельствующая о положительном результате. Отсутствие линии указывает на отрицательный результат. Тест-полоска также имеет контрольную линию в зоне C, которая окрашивается розовым независимо от того, появилась ли линия выявления антигена, и является контролем правильного проведения теста.
Ограничения метода
1. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для диагностики in vitro.
2. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для тестирования мазков из носоглотки и ротоглотки человека. В случае использования других образцов результаты могут быть неверными.
3. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для качественного выявления и не может указывать на уровень антигенов в образце.
4. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 является вспомогательным клиническим диагностическим средством. Если результат теста положительный, то рекомендуется незамедлительно обратиться к другим методам для дальнейшего обследования. Диагноз врача имеет преимущественное значение.
5. На ранней стадии инфекции могут быть получены отрицательные результаты, поскольку уровень антигена низок или антиген еще не появился в образце.
Меры предостороженности
1. Класс в зависимости от потенциального риска применения – 3 в соответствии с номенклатурной классификацией медицинских изделий, утверждаемой приказом Министерства здравоохранения Российской Федерации от 06.06.2012 N 4н (в редакции приказа Минздрава России от 25.09.2014 № 557н «О внесении изменения в приложение № 1 к приказу Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации медицинских изделий»).
2. Внимательно ознакомьтесь с инструкцией перед использованием и строго контролируйте время реакции. В противном случае результаты теста будут неточными.
3. Образец должен тестироваться в лаборатории. Со всеми образцами и материалами во время тестирования следует обращаться в соответствии с лабораторной практикой по инфекционным заболеваниям, а также в соответствии с п. 4.2.3 «Временных методических рекомендаций "Профилактика, диагностика и лечение новой коронавирусной инфекции COVID19"»:
Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
К работе с тест-системами для диагностики COVID-19 в лаборатории организаций допускаются специалисты, давшие письменное согласие и прошедшие инструктаж, проведенный сотрудниками лабораторий Роспотребнадзора, имеющих санитарно-эпидемиологическое заключение на работу с возбудителями инфекционных заболеваний человека II группы патогенности.
Сбор клинического материала и его упаковку осуществляет работник медицинской организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность микроорганизмами II группы патогенности. Каждый образец материала помещают в отдельную транспортную емкость, обеспечивая требования в соответствии с таблицей настоящих методических рекомендаций.
Все образцы, собранные для лабораторных исследований, должны рассматриваться как потенциально инфекционные, и медицинский персонал, который собирает или перевозит клинические образцы, должен строго соблюдать требования биологической безопасности как при работе с микроорганизмами II группы патогенности.
Перевозка образцов должна осуществляться в соответствии с требованиями санитарного законодательства по отношению к микроорганизмам II группы патогенности.
4. Берегите от влаги, не открывайте упаковку, пока образцы для тестирования не будут готовы. Не проводите тестирование, если упаковка повреждена или тестовая кассета является влажной.
5. Используйте набор реагентов в течение срока годности.
6. Перед использованием доведите все реагенты и образцы до комнатной температуры.
7. Не заменяйте компоненты набора компонентами других наборов.
8. Не разбавляйте образец для тестирования.
9. Набор реагентов должен храниться в строгом соответствии с условиями, указанными в данной инструкции.
10. Методы и результаты тестирования должны интерпретироваться в строгом соответствии с данной инструкцией.
11. Если содержание в пробе антигенов SARS-CoV-2 / вирусов гриппа типов A и B в образце окажется ниже минимального предела выявления для данного набора, то будут получены отрицательные результаты.
1. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для диагностики in vitro.
2. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для тестирования мазков из носоглотки и ротоглотки человека. В случае использования других образцов результаты могут быть неверными.
3. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 используется только для качественного выявления и не может указывать на уровень антигенов в образце.
4. Набор реагентов «GT CoV-Influ antigen test», партия 202203-87 является вспомогательным клиническим диагностическим средством. Если результат теста положительный, то рекомендуется незамедлительно обратиться к другим методам для дальнейшего обследования. Диагноз врача имеет преимущественное значение.
5. На ранней стадии инфекции могут быть получены отрицательные результаты, поскольку уровень антигена низок или антиген еще не появился в образце.
Меры предостороженности
1. Класс в зависимости от потенциального риска применения – 3 в соответствии с номенклатурной классификацией медицинских изделий, утверждаемой приказом Министерства здравоохранения Российской Федерации от 06.06.2012 N 4н (в редакции приказа Минздрава России от 25.09.2014 № 557н «О внесении изменения в приложение № 1 к приказу Министерства здравоохранения Российской Федерации от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации медицинских изделий»).
2. Внимательно ознакомьтесь с инструкцией перед использованием и строго контролируйте время реакции. В противном случае результаты теста будут неточными.
3. Образец должен тестироваться в лаборатории. Со всеми образцами и материалами во время тестирования следует обращаться в соответствии с лабораторной практикой по инфекционным заболеваниям, а также в соответствии с п. 4.2.3 «Временных методических рекомендаций "Профилактика, диагностика и лечение новой коронавирусной инфекции COVID19"»:
Все образцы, полученные для лабораторного исследования, следует считать потенциально инфицированными, и при работе с ними должны учитываться требования СП 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Медицинские работники, которые собирают или транспортируют клинические образцы в лабораторию, должны быть обучены практике безопасного обращения с биоматериалом, строго соблюдать меры предосторожности и использовать средства индивидуальной защиты (СИЗ).
К работе с тест-системами для диагностики COVID-19 в лаборатории организаций допускаются специалисты, давшие письменное согласие и прошедшие инструктаж, проведенный сотрудниками лабораторий Роспотребнадзора, имеющих санитарно-эпидемиологическое заключение на работу с возбудителями инфекционных заболеваний человека II группы патогенности.
Сбор клинического материала и его упаковку осуществляет работник медицинской организации, обученный требованиям и правилам биологической безопасности при работе и сборе материала, подозрительного на зараженность микроорганизмами II группы патогенности. Каждый образец материала помещают в отдельную транспортную емкость, обеспечивая требования в соответствии с таблицей настоящих методических рекомендаций.
Все образцы, собранные для лабораторных исследований, должны рассматриваться как потенциально инфекционные, и медицинский персонал, который собирает или перевозит клинические образцы, должен строго соблюдать требования биологической безопасности как при работе с микроорганизмами II группы патогенности.
Перевозка образцов должна осуществляться в соответствии с требованиями санитарного законодательства по отношению к микроорганизмам II группы патогенности.
4. Берегите от влаги, не открывайте упаковку, пока образцы для тестирования не будут готовы. Не проводите тестирование, если упаковка повреждена или тестовая кассета является влажной.
5. Используйте набор реагентов в течение срока годности.
6. Перед использованием доведите все реагенты и образцы до комнатной температуры.
7. Не заменяйте компоненты набора компонентами других наборов.
8. Не разбавляйте образец для тестирования.
9. Набор реагентов должен храниться в строгом соответствии с условиями, указанными в данной инструкции.
10. Методы и результаты тестирования должны интерпретироваться в строгом соответствии с данной инструкцией.
11. Если содержание в пробе антигенов SARS-CoV-2 / вирусов гриппа типов A и B в образце окажется ниже минимального предела выявления для данного набора, то будут получены отрицательные результаты.

Технические характеристики набора реагентов «GT CoV-Influ antigen test», партия 202203-87.


Для проведения клинических испытаний было использовано 86 образцов мазков из носоглотки, 87 образец мазков из ротоглотки, содержащих исследуемые РНК коронавирусной инфекции SARS-CoV-2, вируса гриппа A и вируса гриппа B, а также для оценки перекрестной реактивности образцы, не содержащие исследуемые аналиты, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ), вирусы парагриппа, риновирусы, аденовирусы, человеческие метапневмовирусы), которые были получены из банка остаточных аликвот, сформированного в процессе рутинной лечебно-диагностической практики ФГБУ ФНКЦ ФМБА России, а также подученные из коллекции ФГБУ «НИИ гриппа имени А.А. Смородинцева».
Такое количество образцов было набрано в соответствии с рекомендациями Типовой программы клинических испытаний, а также в соответствии с требованиями ГОСТ Р 51352-2013 и с учетом рекомендаций Международного руководства CLSI EP09-A3.
В ходе клинических испытаний, для установления статуса РНК коронавируса SARS-CoV-2 и вирусов гриппа А, В, использовался зарегистрированный в установленном порядке набор реагентов:
- «Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) и вирусов гриппа А, В, субтипа H1pdm09 (пандемического) гриппа А методом ОТ-ПЦР в режиме "реального времени" "АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)"» LOT: 171021 срок годности до 17.10.2022 производства ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Для клинического материала, не содержащего РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но содержащего другие возбудители инфекционных заболеваний, использовался «Набор реагентов для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса (human Respiratory Syncytial virus - hRSv), метапневмовируса (human Metapneumovirus - hMpv), вирусов парагриппа 1,2, 3 и 4 типов (human Parainfluenza virus - 1-4 - hPiv), коронавирусов (human Coronavirus - hCov), риновирусов (human Rhinovirus - hRv), ДНК аденовирусов групп В, С и Е (human Adenovirus В, С, Е - hAdv) и бокавируса (human Bocavirus - hBov) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® ОРВИ-скрин-FL" по ТУ 9398-155-01897593-2010», производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия (Регистрационное Удостоверение № ФСР 2011/11258 от 26.02.2019).
Испытания проводились по средствам параллельного проспективного исследования диагностических характеристик набора реагентов «GT CoV-Influ antigen test», партия 202203-87 на основании сопоставления результатов тестирования одних и тех же проб клинического материала испытуемым набором реагентов «GT CoV-Influ antigen test», партия 202203-87, производства ООО «ТестГен» и набором сравнения «АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)», ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Свидетельством правильности работы исследуемого медицинского изделия будет совпадение результатов.
При тестировании 86 образцов мазков из носоглотки испытуемым набором реагентов было определено, что:
- у 27 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 25 пациентов (2 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациента (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 24 пациентов (1 ложноотрицательный результат);
При испытании 9 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 2 образца, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
При тестировании 87 образцов мазков из ротоглотки испытуемым набором реагентов было определено, что:
- у 29 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 26 пациентов (3 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациентов (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 23 пациентов (2 ложноотрицательных результата);
При испытании 8 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 1 образец, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
Доверительные интервалы (ДИ) диагностических характеристик будут рассчитаны по методу Клоппера и Пирсона (Clopper-Pearson Confidience Interval; Clopper, C., & Pearson, E. (1934). The Use of Confidence or Fiducial Limits Illustrated in the Case of the Binomial. Biometrika,26(4), 404- 413. doi:10.2307/2331986). Диагностические характеристики испытуемого набора были рассчитаны с доверительной вероятностью 95 %.
Диагностические характеристики испытуемого набора по отношению к каждому исследуемому аналиту в образцах клинического материала человека (мазки из носоглотки, мазки из ротоглотки) приведен в Таблице 4
Такое количество образцов было набрано в соответствии с рекомендациями Типовой программы клинических испытаний, а также в соответствии с требованиями ГОСТ Р 51352-2013 и с учетом рекомендаций Международного руководства CLSI EP09-A3.
В ходе клинических испытаний, для установления статуса РНК коронавируса SARS-CoV-2 и вирусов гриппа А, В, использовался зарегистрированный в установленном порядке набор реагентов:
- «Набор реагентов для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) и вирусов гриппа А, В, субтипа H1pdm09 (пандемического) гриппа А методом ОТ-ПЦР в режиме "реального времени" "АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)"» LOT: 171021 срок годности до 17.10.2022 производства ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Для клинического материала, не содержащего РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но содержащего другие возбудители инфекционных заболеваний, использовался «Набор реагентов для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ): РНК респираторно-синцитиального вируса (human Respiratory Syncytial virus - hRSv), метапневмовируса (human Metapneumovirus - hMpv), вирусов парагриппа 1,2, 3 и 4 типов (human Parainfluenza virus - 1-4 - hPiv), коронавирусов (human Coronavirus - hCov), риновирусов (human Rhinovirus - hRv), ДНК аденовирусов групп В, С и Е (human Adenovirus В, С, Е - hAdv) и бокавируса (human Bocavirus - hBov) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® ОРВИ-скрин-FL" по ТУ 9398-155-01897593-2010», производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия (Регистрационное Удостоверение № ФСР 2011/11258 от 26.02.2019).
Испытания проводились по средствам параллельного проспективного исследования диагностических характеристик набора реагентов «GT CoV-Influ antigen test», партия 202203-87 на основании сопоставления результатов тестирования одних и тех же проб клинического материала испытуемым набором реагентов «GT CoV-Influ antigen test», партия 202203-87, производства ООО «ТестГен» и набором сравнения «АмплиПрайм® SARS-CoV-2 / Flu (A/B/H1pdm09)», ООО "НекстБио", Россия, регистрационное удостоверение №РЗН 2020/12809 от 03.12.2020 г.
Свидетельством правильности работы исследуемого медицинского изделия будет совпадение результатов.
При тестировании 86 образцов мазков из носоглотки испытуемым набором реагентов было определено, что:
- у 27 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 25 пациентов (2 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациента (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 24 пациентов (1 ложноотрицательный результат);
При испытании 9 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 2 образца, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
При тестировании 87 образцов мазков из ротоглотки испытуемым набором реагентов было определено, что:
- у 29 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК SARS-CoV-2 наличие антигена SARS-CoV-2 выявлено у 26 пациентов (3 ложноотрицательных результата).
- у 25 пациентов с подтвержденным набором сравнения положительным результатом на наличие РНК вируса гриппа А (Influenza virus А) наличие антигена вируса гриппа А выявлено у 23 пациентов (2 ложноотрицательных результата);
- у 25 пациентов с подтвержденным положительным набором сравнения результатом на наличие РНК вируса гриппа В (Influenza virus В) наличие антигена вируса гриппа В выявлено у 23 пациентов (2 ложноотрицательных результата);
При испытании 8 образцов мазков из носоглотки, не содержащих РНК вируса SARS-CoV-2, вируса гриппа A и вируса гриппа B, но с подтвержденным положительным наличием возбудителей респираторных инфекций (респираторно- синцитиальный вирус (РСВ) – 3 образцов, вирусы парагриппа – 2 образца, риновирусы – 1 образец, аденовирусы – 1 образец, человеческие метапневмовирусы –1 образец), неспецифических положительных результатов не наблюдалось.
Доверительные интервалы (ДИ) диагностических характеристик будут рассчитаны по методу Клоппера и Пирсона (Clopper-Pearson Confidience Interval; Clopper, C., & Pearson, E. (1934). The Use of Confidence or Fiducial Limits Illustrated in the Case of the Binomial. Biometrika,26(4), 404- 413. doi:10.2307/2331986). Диагностические характеристики испытуемого набора были рассчитаны с доверительной вероятностью 95 %.
Диагностические характеристики испытуемого набора по отношению к каждому исследуемому аналиту в образцах клинического материала человека (мазки из носоглотки, мазки из ротоглотки) приведен в Таблице 4
Оплата картой или наличными курьеру
Чек и отгрузочные документы для юр. лиц
Соблюдаем температурный режим
Доставка по Москве
Самовывоз
Ул. Врубеля 13А
Ежедневно с 11:00 до 21:00
Ежедневно с 11:00 до 21:00
Экспресс-доставка
В течение часа по Москве, в область в пределах 3 часов по тарифам Dostavista, Яндекс
Бесплатная доставка
По Москве в пределах МКАД при сумме заказа от 40,000 рублей
Оплата картой или наличными курьеру
Чек и отгрузочные документы для юр. лиц
Соблюдаем температурный режим
Доставка по Санкт-Петербургу
Самовывоз
Ул. Сизова, д. 2
Ежедневно с 11:00 до 18:00
Ежедневно с 11:00 до 18:00
Экспресс-доставка
В течение часа по СПБ, в область в пределах 3 часов по тарифам Dostavista, Яндекс
Бесплатная доставка
По СПБ в пределах КАД при сумме заказа от 40,000 рублей

Оплата картой или наличными курьеру
Чек и отгрузочные документы для юр. лиц
Соблюдаем температурный режим
Доставка в Регионы
Доставка в регионы
Отправляем в день оплаты по тарифам СДЕК и других транспортных компаний на ваш выбор

ПРОДУКТЫ
КОНТАКТЫ
Москва. ул. Врубеля, дом 13, стр. А
Наш лучший специалист очень занят
Но ради вашего вопроса он бросит все дела!